Trattamento delle acque di torre
1. Depositi di sali insolubili
2. Formazioni biologiche
3. Corrosione
4. Fanghi
5. Formazione di schiuma
Sintomi della formazione di depositi
Rimedi preventivi
Bilancio di concentrazione
Conclusioni
La formazione di depositi si verifica quando la concentrazione delle sostanze disciolte supera il limite di solubilità.
Nel caso del raffreddamento evaporativo, l’aumento di concentrazione avviene naturalmente, poichè l’acqua evaporata per il raffreddamento è pura e quindi i sali tendono ad accumularsi nella restante acqua.
La formazione di depositi si accentua quando siano presenti sostanze con carattere di solubilità inversa (la solubilità diminuisce al crescere della temperatura).
Il principale responsabile delle incrostazioni è il carbonato di calcio che si forma dalla decomposizione del bicarbonato di calcio secondo la reazione
Ca (HCO3)2 = CaCO3+CO2 + H2O
Altre sostanze che provocano depositi sono il solfato e il fosfato di calcio e i sali di magnesio e bario. Il carbonato di calcio è solubile nelle soluzioni acidificate, quando al diminuire del pH nell’acqua le incrostazioni tendono a scomparire. In molti casi l’acqua però è mantenuta alcalina (ossia con pH alto), per ridurre la corrosione e in tale caso i depositi di carbonato di calcio sono più facili.
Per prevedere la tendenza alla formazione di depositi, sia pure con una certa grossolanità, si utilizzano gli indici di saturazione di Langelier oppure di stabilità di Ryznar.
1.1 Indice di LANGELIER o indice di SATURAZIONE
E’ basato sulla relazione: pHC = pCa + pAlc + pS ove:
pHc è il pH di soluzione a una certa temperatura;
pCa è il logaritmo della durezza calcarea espresso in ppm CaCO3;
pAlc è il logaritmo del fattore di alcalinità espresso in ppm CaCO3;
pS è il logaritmo della quantità di solidi sospesi espressa in ppm e misurata alla temperatura dell’acqua al punto di precipitazione.
pH (effettivo) – pHc
se pH è maggiore di pHc, l’acqua tende a formare depositi;
se pH è minore di pHc, l’ acqua è corrosiva ma non forma depositi;
se pH = pHc non si formano depositi e la tendenza corrosiva è debole.
1.2 Indice di RYZNAR o indice di STABILITA’
2 pHc – pH
Tutti i valori dell’indice di stabilità sono positivi (2 pHc è sempre maggiore di pH) e il comportamento dell’acqua varia come segue:
– superiore a 6,5: tendenza a corrodere;
– inferiore a 6: tendenza a formare depositi;
– tra 6,5 e 6: non si formano depositi ma è debolmente corrosiva
Le tendenze dell’acqua vengono corrette con l’aggiunta di opportune sostanze, tenuto anche conto che le previsioni basate sugli indici sono fortemente distorte dal continuo cambiamento delle temperature e delle concentrazioni dell’acqua.
CALCOLO DEGLI INDICI DI:
SATURAZIONE pH – pHc
(LANGELIER) pHc = (9,3 + + ß) – (γ + δ)
STABILITA’ (RYZNAR) 2 pHc – pH
dove:
a) assume valori uguali a:
– 0,1 quando i solidi totali sono presenti in una concentrazione compresa tra 50 e 350 mg/l;
– 0,2 quando i solidi totali sono presenti in una concentrazione, compresa tra 400 e 1100 mg/l;
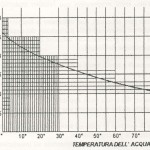
b) ß è funzione della temperatura dell’acqua ed è ricavabile dal diagramma n.1 di seguito riportato;
c) γ rappresenta la durezza calcarea in mg/l CaCO3 mentre δ rappresenta l’alcalinità totale in mg/l CaCO3 .
La somma di γ + δ è data dalla tabella di seguito riportata.
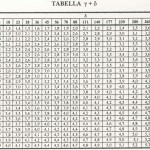
δ = Alcalinità totale ppm CaCo3 (mg/l CaCo3)
γ = Durezza calcarea ppm CaCo3
Testo tratto dal “Manuale del termotecnico” autore Nicola Rossi, editore Hoepli.
